La investigación ambiental sobre isótopos es una herramienta para entender el flujo de agua subterránea regional y confirma, o refuta, las relaciones inferidas entre los acuíferos. La investigación sobre isótopos puede dar información sobre fuentes, edades, tiempos de viaje y trayectoria de flujo de agua subterránea.
El siguiente texto está basado en el artículo “Arid-Zone Hydrology: Investigation with isotope techniques” escrito por H. Hötzl [Hötzl, 1980].
Definición de isótopos
Los isótopos pueden ser definidos como átomos del mismo elemento, diferenciándose por el número de neutrones [Mazor, 1991]. Cada elemento tiene un número constante de protones, puede tener diversos tipos de isótopos dependiendo del número de neutrones.
Por ejemplo, el hidrógeno tiene 3 isótopos:
H – Hidrógeno común, 1 protón
D – Deuterio, hidrógeno estable pesado, 1 protón + 1 neutrón
T – Tritio, hidrógeno radioactivo, 1 protón + 2 neutrones
Y el oxígeno también tiene 3 isótopos:
16O – oxígeno común, 8 protones + 8 neutrones
17O – oxígeno (muy raro) pesado, 8 protones + 9 neutrones
18O – oxígeno pesado, 8 protones + 10 neutrones
Los isótopos pueden ser clasificados en estables y radioactivos (inestables).
Isótopos estables de agua subterránea
Los isótopos estables tienen origen natural, no parecen decaer en otros isótopos en tiempo geológico y pueden ser producidos por el decaimiento de otros isótopos. Los isótopos estables analizados en este trabajo de investigación son el deuterio y el 180.
La composición isotópica estable de un elemento de poca masa se expresa usualmente como "delta" (δ) desviaciones de la composiciión estándar.
δIsótopo (en 0/00) = (Rmuestra/Restándar – 1).1000
Donde: “R” es la tasa de isótopos pesados a livianos.
La composición isotópica del agua en el trabajo de investigación es comparada con el Agua del Océano Media Estándar (Standard Mean Ocean Water - SMOW). Esta composición se expresa con una desviación de miles (0/00) respecto al SMOW.
Para el caso del deuterio:
δD (en 0/00) = ((D/H)muestra / (D/H)SMOW - 1) x 1000
Fraccionamiento isotópico durante la evaporación
Las propiedades físicas y químicas de los diferentes isótopos son levemente distintas debido a sus diferencias de masas. Las partículas ligeras de agua evaporan más eficientemente que las pesadas; como resultado, el fraccionamiento isotópico ocurre. El aire toma las partículas ligeras de agua con valores relativamente negativos de δD y δ18O, mientras que la parte residual es más rica en isótopos pesados. (Más positivos δD y δ18O)
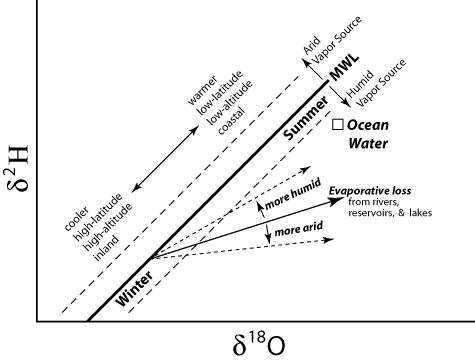
Los valores de δD y δ18O se enriquecen progresivamente cuando se da la evaporación y desarrolla una composición isotópica única. Cuando son ploteados, estos valores tienen una tendencia linear llamada "línea de evaporación" y su pendiente se determina principalmente por la temperatura y la humedad del aire.
Línea de Agua Meteórica Global (GMWL)
Cuando las composiciones isotópicas de precipitaciones de todo el mundo se plotean en δ2H versus δ18O, pueden ser descritas por la ecuación [Craig, 1961]:
δ2H = 8. δ18O + 10 (en 0/00)
La pendiente de 8 se debe a las condiciones de equilibrio durante la condensación de la precipitación en nubes a 25-30 °C. El valor de 10 0/00 en la intersección con el eje Y es llamado el valor de exceso de deuterio. Este valor de exceso de deuterio se aplica sólo a los datos que "encajan" con la pendiente de 8; valores de exceso típicos de deuterio se encuentran en el rango de 0 a 20 [Kendall, 1998] y son un indicador de las condiciones de humedad de la región fuente.
Línea de Agua Meteórica Global y tipos de desviaciones. Fuente: web.sahra.arizona.edu
Isótopos Inestables de Agua Subterránea
Los isótopos radioactivos (inestables) son átomos isótopos que decaen espontáneamente con el tiempo formando otros isótopos que emiten partículas alpha o beta y hasta gamma [Kendall, 1998].
Tritio
El Tritio es un isótopo radioactivo producido naturalmente por la interacción de rayos cósmicos con la atmósfera y artificialmente con la descarga de bombas de fusión principalmente en la estratósfera [Salomon, 2005]. Los valores de tritio se expresan en concentraciones absolutas llamadas unidades de tritio (Tritium Units, TU), donde una unidad TU corresponde a 1 átomo de tritio por 10e-18 átomos de hidrógeno.
El tritio fue producido principalmente al probar armas nucleares a mediados de la década de los 60's. Dependiendo de las unidades TU observadas en muestras de agua, el agua puede ser cualitativamente fechada entre el periodo anterior a las pruebas con las bombas (antes de 1960), posterior a las pruebas con las bombas (desde 1960 a 2005) o una mezcla de ambos.
14C
El carbon-14 es un isótopo radioactivo producido en la atmósfera por la interacción de los neutrones de rayos cósmicos con 14N. El carbono-14 tiene una vida media de 5 730 años y decae a un 14N estable por la emisión de partículas beta.
El carbono-14 puede ser usado para fechar el agua subterránea a edades hasta de 60 000 años, aunque este rango puede ser más corto por la pobre preservación y contaminación del viejo material.
Referencias
Craig, H. - Isotopic variations in meteoric waters - Science, 133, 1702-1703, 1961.
Hötzl,, H. - Arid-Zone Hydrogeology: Investigations with Isotope Techniques – International Atomic Energy Agency, Vienna, 1980.
Mazor, Emanuel -Applied chemical and isotopic groundwater hydrology - Open Univ. Press, 1991.